Hukum Pertama Termodinamika
Oleh: Selvia Indriani (18630033)
Hukum
Pertama Termodinamika
Dalam suatu termodinamika kita akan mengenal Sistem dan juga Lingkungan. Sistem
adalah sesuatu yang menjadi fokus kita atau pusat perhatian kita. Di sekitar
sistem, terdapat lingkungan, yaitu sesuatu yang berada di luar sistem tersebut.
Di antara sistem dan lingkungan terdapat batas-batas yang menjadi pemisah di
antara keduanya. Ada tiga jenis sistem dalam termodinamika:
- Sistem terbuka: pada sistem dan lingkungan terdapat pertukaran massa dan energi. Contoh: Turbin gas.
- Sistem tertutup: hanya terdapat pertukaran energi
saja, massanya tetap. Contoh: balon udara yang dipanaskan.
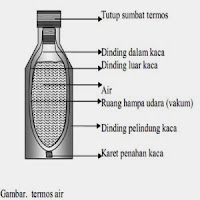
- Sistem terisolasi: tidak memungkinkan adanya pertukaran massa dan energi. Contoh: termos.
Link gambar: https://www.utakatikotak.com/kongkow/detail/16887/Pengertian-Klasifikasi-dan-Sifat-sifat-Sistem-Termodinamika
Konsep dasar dari termodinamika adalah kalor,energi,
dan kerja. Kerja adalah gerak yang
berlawanan dengan gaya sedangkan kalor
adalah transfer energi sebagai akibat adanya perubahan suhu, dan energi adalah kemampuan untuk melakukan
kerja.
Untuk memahami hubungan antara kerja dan panas,kita
perlu memahami faktor penghubungnya, yaitu perubahan energi internal. Energi
internal merupakan energi total dalam sistem. Dalam ilmu fisika, kita tahu
bahwa energi total dalam sistem adalah jumlah keseluruhan dari energi potensial
dengan energi kinetik. Dalam ilmu kimia, energi potensial mengacu pada gaya
antarmolekul dan juga ikatan sedangkan energi kinetik mengacu pada gerak
vibrasi, rotasi, dan translasi dari molekul. Energi internal termasuk ke dalam fungsi
keadaan, dimana nilai energi internal digantungkan pada keadaan awal dan
keadaan akhirnya saja.
∆U = Uf - Ui
Hukum Pertama Termodinamika menyatakan bahwa energi
dapat kita konversikan dari satu bentuk ke bentuk yang lain dengan adanya
interaksi panas, kerja, dan energi internal. Energi juga tidak dapat diciptakan
atau dimusnahkan dalam keadaan apapun. Hukum
ini dapat dinyatakan sebagai:
∆U = W + q
dengan :
∆U = perubahan energi internal
W = kerja
q = kalor
Perubahan energi internal dalam sistem selalu nol:
∆Usistem = - ∆Ulingkungan
Jika sejumlah energi
hilang di dalam sistem maka energi tersebut akan di serap oleh lingkungan.
Sebaliknya, energi yang dilepaskan oleh lingkungan akan di serap oleh sistem.

Komentar
Posting Komentar