Termodinamika : Entalpi
Oleh : Nur Laili Viqih Cahyani (18630024)
Pada saat mempelajari Hukum Termodinamika kesatu maka akan banyak membahas tentang entalpi. Entalpi didefinisikan sebagai jumlah energi suatu sistem atau dapat didefinisikan sebagai kalor pada tekanan yang tetap. Energi memiliki sifat tidak dapat diciptakan atau dimusnahkan, melainkan dapat dikonversi kedalam bentuk berbeda. Untuk dapat memahami entalpi maka harus memahami apa itu sistem dan lingkungan. Sistem adalah suatu objek yang menjadi fokus untuk diteliti. Lingkungan adalah sesuatu yang mempengaruhi sistem yang teletak dibagian luar. Huruf H merupakan lambang dari entalpi. ∆H merupakan besarnya perubahan entalpi yang dapat dihitung dari selisih entalpi dari produk dikurangi dengan entalpi dari reaktan. Apabila nilai entalpi produk lebih besar dari entalpi reaktan maka reaksi tersebut adalah endotermis atau menyerap kalor dari lingkungan, apabila nilai entalpi reaktan lebih besar dari entalpi produk maka reaksi tersebut adalah eksotermis atau melepas kalor ke lingkungan. Reaksi endotermis mengalami penurunan suhu dan reaksi eksotermis mengalami kenaikkan suhu. Adapun rumus dari entalpi adalah:
H=U+PV
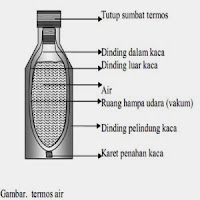
dimana H merupakan lambang dari entalpi, P merupakan lambang dari tekanan, dan V merupakan lambang dari Volume. Adapun faktor yang mempengaruhi entalpi yaitu suhu, tekanan, keadaan fisis zat, dan jumlah zat. Sistem terbuka apabila terjadi perubahan massa, kalor, dan kerja. Energi dan masa dapat keluar atau masuk dalam sistem. Contohnya terjadi pada gelas piala dan tabung reaksi. Sistem tertutup tidak mengalami perubahan massa, akan tetapi mengalami perubahan kalor dan kerja. Sistem terisolasi terjadi apabila tidak ada perubahan pada massa, kalor, dan kerja. Sistem adiabatik, apabila terjadi perubahan massa dan kerja, akan tetapi tidak mengalami perubahan kalor. Untuk menggeser suhu pada sistem adiabatik dibutuhkan perubahan tekanan, akan tetapi tidak mempengaruhi lingkungan. Pada system adibatik kerja bernilai negative dan energy bernilai positif. Energy akan berbanding lurus dengan suhu, apabila suhu dinaikkan maka energy akan semakin naik juga, begitupun sebaliknya. Contohnya terjadi pada alat termos. Entalpi standart atau ∆H° merupakan perubahan entalpi yang terjadi pada reaktan dan produk saat keadaan standart, dengan Satuan Internasional (SI) adalah joule. Entalpi penguraian merupakan kalor yang dibutuhkan untuk mengurai 1 mol pada keadaan standart. Entalpi pembakaran merupakan jumlah kalor yang dibutuhkan dalam proses pembakaran dalam keadaan standart. Proses isothermal terjadi apabila tidak mengalami perubahan suhu atau konstan, akan tetapi mengalami perubahan kalor yang ditambahkan pada system.
Pada saat mempelajari Hukum Termodinamika kesatu maka akan banyak membahas tentang entalpi. Entalpi didefinisikan sebagai jumlah energi suatu sistem atau dapat didefinisikan sebagai kalor pada tekanan yang tetap. Energi memiliki sifat tidak dapat diciptakan atau dimusnahkan, melainkan dapat dikonversi kedalam bentuk berbeda. Untuk dapat memahami entalpi maka harus memahami apa itu sistem dan lingkungan. Sistem adalah suatu objek yang menjadi fokus untuk diteliti. Lingkungan adalah sesuatu yang mempengaruhi sistem yang teletak dibagian luar. Huruf H merupakan lambang dari entalpi. ∆H merupakan besarnya perubahan entalpi yang dapat dihitung dari selisih entalpi dari produk dikurangi dengan entalpi dari reaktan. Apabila nilai entalpi produk lebih besar dari entalpi reaktan maka reaksi tersebut adalah endotermis atau menyerap kalor dari lingkungan, apabila nilai entalpi reaktan lebih besar dari entalpi produk maka reaksi tersebut adalah eksotermis atau melepas kalor ke lingkungan. Reaksi endotermis mengalami penurunan suhu dan reaksi eksotermis mengalami kenaikkan suhu. Adapun rumus dari entalpi adalah:
H=U+PV
dimana H merupakan lambang dari entalpi, P merupakan lambang dari tekanan, dan V merupakan lambang dari Volume. Adapun faktor yang mempengaruhi entalpi yaitu suhu, tekanan, keadaan fisis zat, dan jumlah zat. Sistem terbuka apabila terjadi perubahan massa, kalor, dan kerja. Energi dan masa dapat keluar atau masuk dalam sistem. Contohnya terjadi pada gelas piala dan tabung reaksi. Sistem tertutup tidak mengalami perubahan massa, akan tetapi mengalami perubahan kalor dan kerja. Sistem terisolasi terjadi apabila tidak ada perubahan pada massa, kalor, dan kerja. Sistem adiabatik, apabila terjadi perubahan massa dan kerja, akan tetapi tidak mengalami perubahan kalor. Untuk menggeser suhu pada sistem adiabatik dibutuhkan perubahan tekanan, akan tetapi tidak mempengaruhi lingkungan. Pada system adibatik kerja bernilai negative dan energy bernilai positif. Energy akan berbanding lurus dengan suhu, apabila suhu dinaikkan maka energy akan semakin naik juga, begitupun sebaliknya. Contohnya terjadi pada alat termos. Entalpi standart atau ∆H° merupakan perubahan entalpi yang terjadi pada reaktan dan produk saat keadaan standart, dengan Satuan Internasional (SI) adalah joule. Entalpi penguraian merupakan kalor yang dibutuhkan untuk mengurai 1 mol pada keadaan standart. Entalpi pembakaran merupakan jumlah kalor yang dibutuhkan dalam proses pembakaran dalam keadaan standart. Proses isothermal terjadi apabila tidak mengalami perubahan suhu atau konstan, akan tetapi mengalami perubahan kalor yang ditambahkan pada system.
Komentar
Posting Komentar