Termodinamika : Kalorimeter
Oleh: Bunga Surya Eka Sari (18630108)
Dalam mempelajari termodinamika, pasti tidak akan jauh dari kalor. Apa sih kalor itu, dan apa sih alat yang digunakan untuk mengukur kalor?
Kalor merupakan energi panas yang dapat melakukan perpindahan dari suhu tinggi suatu benda menuju ke benda bersuhu rendah melalui sebuah medium perantara, alat yang digunakan adalah kalorimeter. Dibawah akan kita bahas mengenai kalorimeter.
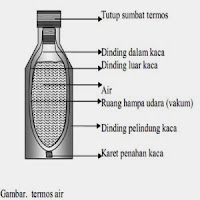
Kalorimeter merupakan sebuah alat yang dapat digunakan untuk menentukan banyaknya kalori yang terlibat di dalam reaksi kimia dengan cara mengukur perubahan suhunya dan perubahan termal zat. Perpindahan kalor dari system ke lingkungan sekitar dilakukan sampai minimum menggunakan kalorimeter. Suatu kalorimeter, terdiri dari dua bejana dan diantara bejana tersebut terdapat ruang udara yang memisahkannya. Bejana yang berada didalam dapat digunakan untuk mengurangi penyerapan kalor oleh dinding bejana, karena bejana yang berada di dalam terbuat dari alumunium yang mengkilat. Pada bejana juga terdapat tutup yang terbuat dari sesuatu yang mempunyai sifat penghantar kalor yang buruk sehingga tidak banyak menghilangkan panas, dan biasanya terbuat dari kayu yang sulit menyerap panas.
Prinsip kerja dari kalorimeter berdasarkan pada asas black, dimana panas yang hilang atau dilepas akan sama dengan panas yang diterima atau diserap. Arus listrik dialirkan dalam sebuah kumparan kawat penghantar kemudian dimasukan dalam air suling. Kawat penghantar tersebut akan bergerak (karena terdapat perbedaan potensial) pembawa muatan yang bertumbukan dengan atom logam dan kehilangan energy. Hal tersebut mengakibatkan kawat pembawa muatan akan bertumbukan dengan kecepatan yang konstan, dan setara dengan kuat medan listriknya. Yang mana pembawa muatan mengalami tumbukan dan mengakibatkan adanya energy berupa panas yang diperoleh setelah logam dialiri oleh arus listrik.
Kalorimeter memiliki berbagai jenis diantaranya adalah kalorimeter bom, elektrik, alumunium dan sederhana. Dibawah akan dibahas mengenai kalorimeter sederhana:
Kalorimeter Sederhana
Kalorimeter sederhana merupakan kalorimeter dimana tekanannya tetap. Kalorimeter ini terbuat dari gelas styrofoam. Pada dasarnya kalorimeter ini digunakan untuk reaksi, dimana reaksi tersebut terjadi didalam fase larutan. Misalkannya saja reaksi netralisasi larutan asam-basa . rumus dari kalor reaksi kalorimeter sederhana adalah:
qReaksi = -(qLarutan + qKalorimeter)
qKalorimeter = CKalorimeter x ΔT
Jika harga dari kapasitas kalor (C) sangat kecil, kalor dari kalorimeter bisa kita abaikan akibatnya, perubahan dari kalor dapat kita anggap hanya berakibat pada kenaikan suhu larutan didalam kalorimeter.
qReaksi = -qLarutan
qLarutan = m. c. ΔT
Dengan :
q = Jumlah dari kalor yang akan diterima ataupun dilepaskan oleh suatu benda (Joule)
m = berat suatu benda (kilogram)
c = kalor jenis (JKg-1◦C-1)
ΔT = Perubahan temperature (◦C )
Sumber:
Chang, Raymond. 2003. Kimia Dasar Jilid I Edisi 3.Jakarta: Erlangga
Dalam mempelajari termodinamika, pasti tidak akan jauh dari kalor. Apa sih kalor itu, dan apa sih alat yang digunakan untuk mengukur kalor?
Kalor merupakan energi panas yang dapat melakukan perpindahan dari suhu tinggi suatu benda menuju ke benda bersuhu rendah melalui sebuah medium perantara, alat yang digunakan adalah kalorimeter. Dibawah akan kita bahas mengenai kalorimeter.
Kalorimeter merupakan sebuah alat yang dapat digunakan untuk menentukan banyaknya kalori yang terlibat di dalam reaksi kimia dengan cara mengukur perubahan suhunya dan perubahan termal zat. Perpindahan kalor dari system ke lingkungan sekitar dilakukan sampai minimum menggunakan kalorimeter. Suatu kalorimeter, terdiri dari dua bejana dan diantara bejana tersebut terdapat ruang udara yang memisahkannya. Bejana yang berada didalam dapat digunakan untuk mengurangi penyerapan kalor oleh dinding bejana, karena bejana yang berada di dalam terbuat dari alumunium yang mengkilat. Pada bejana juga terdapat tutup yang terbuat dari sesuatu yang mempunyai sifat penghantar kalor yang buruk sehingga tidak banyak menghilangkan panas, dan biasanya terbuat dari kayu yang sulit menyerap panas.
Prinsip kerja dari kalorimeter berdasarkan pada asas black, dimana panas yang hilang atau dilepas akan sama dengan panas yang diterima atau diserap. Arus listrik dialirkan dalam sebuah kumparan kawat penghantar kemudian dimasukan dalam air suling. Kawat penghantar tersebut akan bergerak (karena terdapat perbedaan potensial) pembawa muatan yang bertumbukan dengan atom logam dan kehilangan energy. Hal tersebut mengakibatkan kawat pembawa muatan akan bertumbukan dengan kecepatan yang konstan, dan setara dengan kuat medan listriknya. Yang mana pembawa muatan mengalami tumbukan dan mengakibatkan adanya energy berupa panas yang diperoleh setelah logam dialiri oleh arus listrik.
Kalorimeter memiliki berbagai jenis diantaranya adalah kalorimeter bom, elektrik, alumunium dan sederhana. Dibawah akan dibahas mengenai kalorimeter sederhana:
Kalorimeter Sederhana
qReaksi = -(qLarutan + qKalorimeter)
qKalorimeter = CKalorimeter x ΔT
Jika harga dari kapasitas kalor (C) sangat kecil, kalor dari kalorimeter bisa kita abaikan akibatnya, perubahan dari kalor dapat kita anggap hanya berakibat pada kenaikan suhu larutan didalam kalorimeter.
qReaksi = -qLarutan
qLarutan = m. c. ΔT
Dengan :
q = Jumlah dari kalor yang akan diterima ataupun dilepaskan oleh suatu benda (Joule)
m = berat suatu benda (kilogram)
c = kalor jenis (JKg-1◦C-1)
ΔT = Perubahan temperature (◦C )
Sumber:
Chang, Raymond. 2003. Kimia Dasar Jilid I Edisi 3.Jakarta: Erlangga

Komentar
Posting Komentar